
g-links's blog
本ブログは,WEBサイト 神経行動解析リンクス (Neurobehavioral Links)
https://sites.google.com/view/behavior100/
の内容に基づいています。
マーモセット脳画像解析
1. 正常マーモセット脳の基本サイズ
1.1. マーモセットとカニクイザルの脳
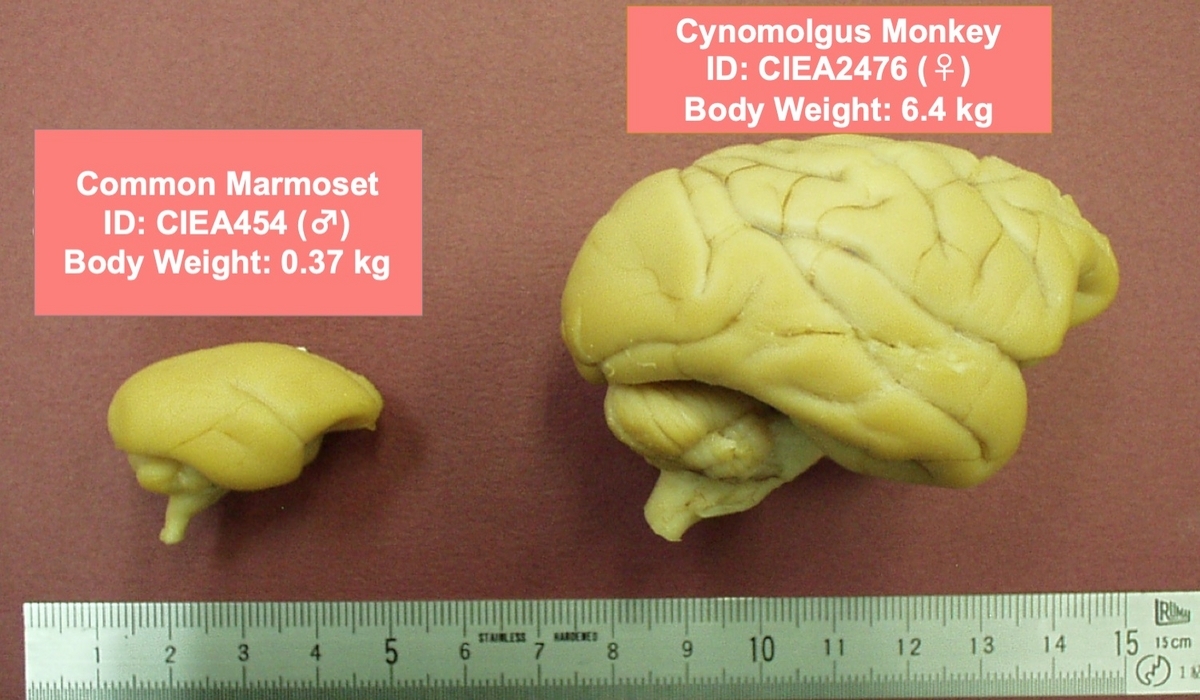 図1. マーモセット脳は,カニクイザルなどのマカク属サルと比べると当然ながら小さい。しかし,それぞれの体重に対する脳の比率を考えると,マーモセットの脳は,マカク属サルに比べて相対的に極めて大きいといえよう(写真は著者らの実験室で撮影)。
図1. マーモセット脳は,カニクイザルなどのマカク属サルと比べると当然ながら小さい。しかし,それぞれの体重に対する脳の比率を考えると,マーモセットの脳は,マカク属サルに比べて相対的に極めて大きいといえよう(写真は著者らの実験室で撮影)。
文献:安東潔 (2008) マーモセットを用いた病態モデル:パーキンソン病モデル, マーモセット MR脳アトラス (岡野栄之/野村達次 監修)。
1.2. マーモセットと齧歯類の脳
 図2. マーモセットの脳は,ラットより明らかに大きい。マーモセットの体重は,大きめの成熟ラットと同程度であることを考えると,ここでもマーモセット脳は,相対的には極めて大きいといえよう。図は,脳の水平断面で,上段は脳を上からみたもので,下段は脳を底部からみたものである。マストミス (Mastomys: Mastomys natalensis) は,西アフリカに生息する齧歯類で,ラッサ熱などの感染研究に使用された(脳サンプル採取および写真撮影:田中慎氏ならびに斎藤亮一氏)。
図2. マーモセットの脳は,ラットより明らかに大きい。マーモセットの体重は,大きめの成熟ラットと同程度であることを考えると,ここでもマーモセット脳は,相対的には極めて大きいといえよう。図は,脳の水平断面で,上段は脳を上からみたもので,下段は脳を底部からみたものである。マストミス (Mastomys: Mastomys natalensis) は,西アフリカに生息する齧歯類で,ラッサ熱などの感染研究に使用された(脳サンプル採取および写真撮影:田中慎氏ならびに斎藤亮一氏)。
文献:安東潔 (2008) マーモセットを用いた病態モデル:パーキンソン病モデル, マーモセット MR脳アトラス (岡野栄之/野村達次 監修)。https://sites.google.com/view/behavior100/%E7%A5%9E%E7%B5%8C%E8%A1%8C%E5%8B%95%E8%A7%A3%E6%9E%90%E8%AB%96%E6%96%87
2. 正常マーモセット脳とパーキンソン病
モデルマーモセット脳
パーキンソン病モデルマーモセット脳:神経毒 MPTP 皮下投与により作成
MPTP : 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine
下記いずれの脳画像も線条体 (Striatum) 内の尾状核 (Caudate)と被殻 (Putamen)が表れる冠状断面
2.1. Tyrosinhydroxilase (TH)
免疫組織染色
 図3. 左に示した正常脳のTH 免疫染色では,線条体 (Striatum) のうち尾状核 (Caudate) と被殻 (Putamen) に染色がみられ,ドーパミン(カテコールアミン)神経の分布が示されている。一方,右に示した MPTP処置マーモセットの脳では,線条体での染色がほとんどみられず,神経に変性脱落があったと分かる。冠状断面の脳スライスは,正常脳で線条体に染色が明確に現れる部分について示した(脳標本画像作成:川井健司氏)。
図3. 左に示した正常脳のTH 免疫染色では,線条体 (Striatum) のうち尾状核 (Caudate) と被殻 (Putamen) に染色がみられ,ドーパミン(カテコールアミン)神経の分布が示されている。一方,右に示した MPTP処置マーモセットの脳では,線条体での染色がほとんどみられず,神経に変性脱落があったと分かる。冠状断面の脳スライスは,正常脳で線条体に染色が明確に現れる部分について示した(脳標本画像作成:川井健司氏)。
文献:
Ando K, Inoue T, Hikishima K, Komaki Y, Kawai K, Inoue R, Nishime C, Nishinaka E, Urano K, Okano H (2020) Measurement of baseline locomotion and other behavioral traits in a common marmoset model of Parkinson's disease established by a single administration regimen of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine: providing reference data for efficacious preclinical evaluations. Behav Pharmacol 31:45-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6964884/pdf/bpharm-31-45.pdf
2.2. オートラジオグラフィーによる
[11C]PE2I リガンド結合

図4. 左に示した正常脳では,ドーパミン トランスポーターのリガンド [11C] PE2I 結合から,線条体(尾状核と被殻)のドーパミン神経分布が示されている。右に示した MPTP処置マーモセットの脳では,線条体でのリガンド結合がみられず,ドーパミン神経の変性脱落が示された(脳標本画像作成:前田純氏)。
文献:
安東潔 (2008) マーモセットを用いた病態モデル:パーキンソン病モデル, マーモセット MR脳アトラス (岡野栄之/野村達次 監修)。
https://sites.google.com/view/behavior100/%E7%A5%9E%E7%B5%8C%E8%A1%8C%E5%8B%95%E8%A7%A3%E6%9E%90%E8%AB%96%E6%96%87
Ando K, Maeda J, Inaji M, Okauchi T, Obayashi S, Higuchi M, Suhara T, Tanioka Y (2008) Neurobehavioral protection by single dose l-deprenyl against MPTP-induced parkinsonism in common marmosets. Psychopharmacology 195:509-516.
https://researchmap.jp/read0179769/published_papers/3505333
2.3. Magnetic Resonance Imaging (MRI)
による T2強調画像

Ando K, Inoue T, Hikishima K, Komaki Y, Kawai K, Inoue R, Nishime C, Nishinaka E, Urano K, Okano H (2020) Measurement of baseline locomotion and other behavioral traits in a common marmoset model of Parkinson's disease established by a single administration regimen of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine: providing reference data for efficacious preclinical evaluations. Behav Pharmacol 31:45-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6964884/pdf/bpharm-31-45.pdf
Hikishima K, Ando K, Komaki Y, Kawai K, Yano R, Inoue T, Ito T, Yamada M, Momoshima S, Okano SJ, Okano H (2015) Voxel-based morphometry of the marmoset brain: in vivo detection of volume loss in the substantia nigra of the MPTP-treated Parkinson's disease model. Neuroscience 300:585–592.
https://pubmed.ncbi.nlm.nih.gov/26012491/
Hikishima K, Ando K, Yano R, Kawai K, Komaki Y, Inoue T, Itoh T, Yamada M, Momoshima S, Okano JS, Okano H (2015) Parkinson disease: diffusion MR imaging to detect nigrostriatal pathway loss in a marmoset model treated with 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine. Radiology 275:430–437.
https://pubmed.ncbi.nlm.nih.gov/25602507/
2.4. Positron Emission Tomography (PET) による
リガンド[11C]PE2I 特異結合能
図6. 左の正常脳では,線条体(尾状核と被殻)に [11C]PE2Iの高い特異結合能がみられ,ドーパミン神経の分布が捉えられている。右の MPTP処置マーモセットの脳には,結合能の著しい低下がみられ,ドーパミン神経の変性脱落が示された(PET測定/解析/画像作成:大林茂氏ならびに永井祐司氏)。
文献:
Ando K, Obayashi S, Nagai Y, Oh-Nishi A, Minamimoto T, Higuchi M, et al. PET analysis of dopaminergic neurodegeneration in relation to immobility in the MPTP-treated common marmoset, a model for Parkinson's disease. PLoS One. 2012;7:e46371.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0046371
3. MPTP皮下投与を受けたマーモセットにおける
脳の画像解析値と行動 (Locomotion)との高い相関性

図7. MPTP皮下投与を受けたマーモセットでは,パーキンソン病様の主要症候の一つである無動がみられる。これは,個別ケージ内のマーモセットの自発運動量 (Locomotion or Spontaneous motor activity) を長期間にわたり連続測定することで,運動量の低下として客観的定量的に測定できる。この指標値とそのマーモセット脳の PET 測定による [11C]PE2I 特異結合能は,線条体とくに被殻において,左図のごとく高い相関を示した (r=0.97)。また,右図の死後脳のTH免疫染色においても,生存時の Locomotion 低下は,線条体全体の免疫染色面積の減少と高い相関を示した。免疫染色面積の定量化は, NIH Image J によって算出した。このことにより,脳の in vivo 測定結果と in vitro 結果と,更には行動との間に明確な対応がみられたといえる。
文献:
Ando K, Obayashi S, Nagai Y, Oh-Nishi A, Minamimoto T, Higuchi M, et al. PET analysis of dopaminergic neurodegeneration in relation to immobility in the MPTP-treated common marmoset, a model for Parkinson's disease. PLoS One. 2012;7:e46371.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0046371
Ando K, Inoue T, Hikishima K, Komaki Y, Kawai K, Inoue R, Nishime C, Nishinaka E, Urano K, Okano H (2020) Measurement of baseline locomotion and other behavioral traits in a common marmoset model of Parkinson's disease established by a single administration regimen of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine: providing reference data for efficacious preclinical evaluations. Behav Pharmacol 31:45-60.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6964884/pdf/bpharm-31-45.pdf
安東潔 (2018) 神経毒MPTP 投与によるコモンマーモセットのパーキンソン病モデル– 行動解析による前臨床評価を中心として – オベリスク Vol.23,1:14-22。
https://researchmap.jp/read0179769/published_papers/19447809


